我國對醫療器械生產質量管理體系的探索,是從植入性醫療器械以及無菌醫療器械開始入手的。原**藥品監督管理局曾于2001、2002年先后發布《一次性使用無菌醫療器械產品(注、輸器具)生產實施細則》和《一次性使用麻醉穿刺包生產實施細則》兩份規范性文件。在此基礎上,SFDA連發《無菌醫療器械實施細則(試行)》和《植入性醫療器械實施細則(試行)》兩大細則,并就植入性醫療器械和無菌醫療器械頒布相應《檢查評定標準》,初步構建了以醫療器械GMP規范為**的醫療器械生產質量管理規范體系。時隔五年之后,2014年12月,**食品藥品監督管理總局(CFDA)發布了新版《規范》,并啟動了配套細則的修訂工作。

2015年1月,CFDA發布《醫療器械生產企業供應商審核指南》,為醫療器械生產企業審核選擇供應商指明了原則和方向,體現了CFDA加強醫療器械生產質量管理,升級醫療器械GMP規范體系的決心。自2018年1月1日起,所有醫療器械生產企業應當符合醫療器械生產質量管理規范的要求。
新版《規范》及其配套文件《醫療器械生產質量管理規范》
《醫療器械生產質量管理規范附錄無菌醫療器械》
《醫療器械生產質量管理規范附錄植入性醫療器械》
《醫療器械生產質量管理規范附錄體外診斷試劑》
《醫療器械生產質量管理規范附錄定制式義齒》
《醫療器械生產質量管理規范現場檢查指導原則》
《醫療器械生產質量管理規范無菌醫療器械現場檢查指導原則》
《醫療器械生產質量管理規范植入性醫療器械現場檢查指導原則》
《醫療器械生產質量管理規范體外診斷試劑現場檢查指導原則》
《醫療器械生產質量管理規范定制式義齒現場檢查指導原則》

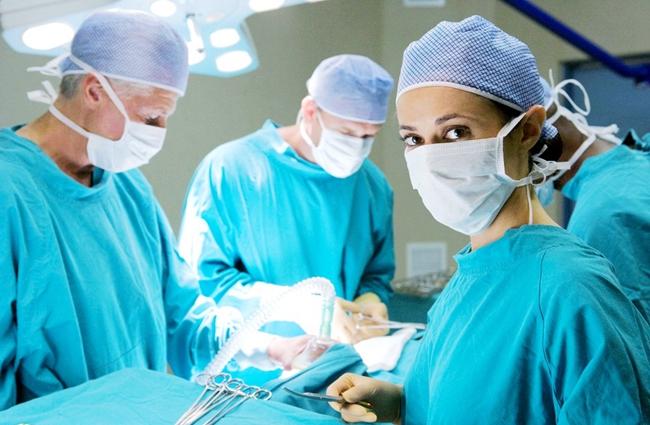
無菌醫療器械生產中應當采用使污染降至.低限的生產技術,以**醫療器械不受污染或能有效排除污染。植入和介入到血管內及需要在萬級下的局部百級潔凈區內進行。后續加工的無菌醫療器械或單包裝出廠的配件,其末道清洗、組裝、初包裝及其封口等生產區域應不低于10,000級潔凈度級別。植入到人體組織、與血液、骨髓腔或非自然腔道直接或間接接入的無菌醫療器械或單包裝出廠的配件,其(不清洗)零部件的加工、末道清洗、組裝、初包裝及其封口等生產區域應不低于100,000級潔凈度級別。與人體損傷表面和粘膜接觸的無菌醫療器械或單包裝出廠的(不清洗)零部件的加工、末道精洗、組裝、初包裝及其封口均應在不低于300,000級潔凈室(區)內進行。對于有要求或采用無菌操作技術加工的無菌醫療器械(包括醫用材料),應在10,000級下的局部100級潔凈室(區)內進行生產。
天泰環境,致力于受控環境(潔凈)系統整體方案解決,秉承“專業、誠信、環保、**”的管理理念,承載信任創造價值。公司具有多類別醫療器械GMP凈化車間設計及施工總承包經驗,所承建項目均都一次性順利通過**GMP**工作。在不斷拓展業余的同時,我公司及時了解學習.新的行業規范和**標準要求,整合**的行業資源及**的施工組織,體現自身的綜合實力優勢,在凈化裝飾圍護、凈化空調通風、電氣動力、照明通訊、安防自控、工藝管道及設備安裝等專業工程中均能做出較高的施工水平,**滿足客戶高標準、高質量、**率的項目要求。




 當前位置:
當前位置:

 熱門推薦
熱門推薦






























 推薦新聞
推薦新聞
 在線留言
在線留言 詳情內容
詳情內容







